Diário O Iguassú


Nós utilizamos cookies para aprimorar a sua experiência em nosso site. Ao fechar este banner ou continuar na página, você concorda com o uso de cookies.
Saiba MaisSua solicitação foi processada com sucesso!
Ocorreu um erro ao processar sua solicitação, por favor tente novamente.
O ICC se esforça para fornecer o melhor conselho possível de um consórcio internacional de médicos familiarizados com a FOP. O objetivo é incentivar pesquisas científicas seguras, precisas e eficazes sobre tratamentos e cuidados efetivos para pacientes com FOP. Tem havido muitas terapias propostas para a FOP, algumas que não provaram ser eficazes e algumas que prejudicaram pacientes com FOP.
Conforme detalhado na carta aberta do ICC, o ICC atualmente não tem uma opinião sobre a eficácia do FOPCon neste momento. O fato é que muitas das alegações de eficácia têm sido através da mídia social ou da publicidade na TV e não através do processo de revisão científica internacionalmente aceito. Nós, como comunidade, não temos dados suficientes para dizer que funciona ou não funciona.
O ICC incentiva a equipe do Palhares a compartilhar publicamente seus dados de maneira aberta e revisada por pares antes de declarar publicamente que eles têm um tratamento. Isso é fundamental para que outros possam ajudar a entender, replicar e determinar o quão bem o FOPCon funciona. Até o momento, todas as alegações públicas de segurança e eficácia nos 40 pacientes que dizem ter sido tratados com o FOPCon foram limitadas a um relato de caso de 3 indivíduos e dispersos relatos de casos individuais na literatura. Entender como os outros 37 sujeitos se saíram, com dados objetivos, é crítico antes que alguém pule para uma conclusão sobre o FOPCon.
O ICC simplesmente solicita que o FOPCon seja descrito como uma terapia potencial, não uma terapia real, como atualmente é retratada nas mídias sociais.
O ICC também aconselha que haja uma discussão com a equipe médica dos pacientes antes de tomar o FOPCon ou qualquer outra terapia potencial. As interações medicamentosas e os riscos individuais variam, e isso deve ser discutido no nível individual. Alegações de segurança na mídia social não são o mesmo que uma discussão aberta de riscos potenciais. O ICC acredita na escolha individual. Se alguém toma uma terapia potencial, ou sente que uma terapia funciona, é um julgamento individual que deve ser feito com todos os riscos e benefícios disponíveis claramente apresentados.
A ICC concorda que a pesquisa futura deve ser apoiada e incentiva a IFOPA e as agências de financiamento a apoiar os esforços com base no mérito potencial de um medicamento. No caso do FOPCon, concordamos que os relatórios individuais sugerem que uma investigação mais detalhada precisa ser feita. No entanto, uma vez que os dados existentes foram coletados, o conjunto completo de dados deve ser compartilhado através de publicações para que todos possam avaliar se esta é a terapia certa para eles e os estudos de pesquisa apropriados podem ser feitos. Este é o mesmo padrão que é aplicado universalmente antes que alguém possa afirmar que uma terapia potencial é uma terapia.
O ICC respeita o grupo Palhares e as muitas outras equipes internacionais que estão buscando tratamentos para a FOP. O ICC simplesmente sente que as reivindicações públicas de eficácia e segurança são prematuras, sem os dados sistemáticos para respaldá-lo. O ICC acredita que a comunidade de FOP merece ter uma discussão aberta e objetiva sobre o FOPCon ou qualquer outra terapia potencial, onde os dados possam ser revisados abertamente e o potencial como tratamento possa ser avaliado objetivamente.Em nome do Comitê de Ensaios Clínicos do Conselho Clinico Internacional em FOP (o ICC):
O ICC está ciente da recente publicação do grupo Palhares sobre o FOPCon e um novo vídeo do YouTube (disponível em alguns países- parece não estar disponível nos EUA ou na Europa) apoiando o FOPCon. O FOPCon é uma terapia proposta composta de ácido ascórbico (vitamina C) e propranolol.
Especificamente, o ICC solicitou o seguinte:
O ICC confirma que as recomendações de tratamento recentemente revisadas em detalhes e
publicadas nas diretrizes de tratamento de 2019 da FOP
(link) não foram
alteradas neste momento. Nós e outros aguardamos a revisão de dados adicionais
publicados sobre como a terapia proposta FOPCon pode beneficiar a comunidade de FOP.
Também encorajamos a comunidade da FOP a avaliar criticamente os riscos, benefícios e
força dos dados de apoio a qualquer outra terapia proposta para a FOP. Pacientes com FOP
que estão considerando qualquer mudança de medicação devem discutir suas opções e
potenciais riscos e benefícios com seus médicos e equipe médica antes de iniciar qualquer
tratamento em potencial.
O Conselho Clínico Internacional sobre FOP (O ICC) é um grupo autônomo e independente de 21 médicos reconhecidos internacionalmente que são especialistas clínicos em FOP de 13 nações (Argentina, Austrália, Brasil, China, França, Alemanha, Itália, Japão, Holanda, África do Sul, Coreia do Sul, Reino Unido e Estados Unidos) e seis continentes (África, Ásia, Austrália, Europa, América do Norte e América do Sul). O ICC foi criado para coordenar e consolidar uma voz global para as melhores práticas de atendimento clínico e pesquisa clínica para pessoas que sofrem com a FOP. O ICC publica as Diretrizes de Tratamento Clínico da FOP, que são usadas internacionalmente para orientar a gestão de pacientes com FOP. O ICC também publicou recomendações importantes para ensaios clínicos testando terapias potenciais para a FOP.
Para a maioria das pessoas com FOP, a série de imunizações infantis estará completa antes do diagnóstico de FOP. Entretanto, para aqueles que foram diagnosticados mais cedo, há um conflito no que diz respeito às imunizações.
O que devem fazer? Não receber a imunização para evitar o risco de ossificação
heterotópica e correr o risco de contrair uma doença séria que poderia ser evitada
pelas vacinas?
Ou deveriam se proteger contra estas doenças, em que pese o risco substancial
de provocar uma ossificação ectópica associada a incapacidade permanente?
Os pais de crianças com FOP devem discutir estes assuntos com seus pediatras. De todas maneiras, qualquer um que tenha contato doméstico com pacientes com FOP deve ser vacinado com todas as imunizações recomendadas.
Em um futuro próximo, o Comité para Doenças Infecciosas da Academia Americana de Pediatria e o Conselho para Práticas de Imunizações do CDC, se reunirão para discutir esta questão. Assim, espera-se ter em breve uma resposta definitiva. Se e quando uma recomendação oficial for feita sobre esta questão, ela será publicada na página da IFOPA.
O Conselho para Práticas de Imunizações (ACIP, sua sigla em inglês), do Centro para Controle e Prevenção de Doenças (CDC) e a Academia Americana de Pediatria (AAP), recomendaram uma serie de rotinas de imunização para bebês, crianças e adultos (MMWR,2006). Estas imunizações diminuíram drasticamente as taxas de doença e morte de várias doenças infecciosas. Várias destas imunizações são uma exigência para os alunos entrarem na escola.
O ACIP e a AAP recomendam que a maioria destas imunizações seja administrada pela via intramuscular (IM), um procedimento que coloca aos pacientes com FOP, em risco de ossificações heterotópicas no local da injeção (Lanchoney, et al., 1995).
No entanto, varias vacinas podem ser aplicadas por via subcutânea (SC) e ainda serão efetivas em proteger contra doenças específicas. As vacinas que podem ser aplicadas pela via SC são:
As vacinas listadas a seguir só podem ser administradas de forma intramuscular. A administração via SC ou intradérmica, pode causar irritação local severa, induração, decoloração da pele, inflamação e formação de granuloma. Por tanto não devem ser administradas. As vacinas que a ACIP e a AAP determinaram que podem ser aplicadas somente por via IM são:
A vacina da gripe nunca deve ser administrada a quem tem alergia a ovo (desde que é desenvolvida e cultivada em ovos.) A vacina da gripe também não deve ser administrada a alguém que já teve uma reação adversa severa a essa vacina. Mais importante ainda, a vacina da gripe nunca deve se administrar a um paciente de FOP durante um surto da doença, quando ela está ativa.
Se a gripe for contraída, podem ser considerados inibidores da neuraminidase (Moscona, 2005), mas existe pouca experiência com eles na comunidade FOP.
Uma vacina intranasal contra a gripe foi aprovada pela FDA (Anvisa americana) e agora está disponível para administração quando não existam contraindicações em indivíduos de 5 a 49 anos de idade.
Apenas uma pequena parcela desse grande número sabe que os pacientes portadores destes males têm direitos especiais, como acesso ao tratamento, auxílio-doença e isenção de determinados impostos. A Organização Mundial da Saúde (OMS) classifica como doenças raras aquelas que atingem 65 em cada 100 mil habitantes.
Conforme orienta a advogada Claudia Nakano, especialista em direitos da
saúde: O paciente pode recorrer ao Poder Judiciário em face do SUS ou
do plano de saúde e requerer uma medida antecipatória garantindo o seu
tratamento. As medidas antecipatórias são julgadas em menos de uma semana.
Com o deferimento da tutela antecipatória, o plano de saúde ou o SUS são
obrigados a fornecer o medicamento rapidamente, sob pena de multa?
A advogada lista os demais direitos garantidos aos pacientes portadores de doenças raras:
TFD ? tratamento fora de domicílio, quando necessário. Se o paciente se sentir lesado ao buscar esses direitos deve recorrer a Justiça para valer os seus direitos.
Referências: clique aqui - Acesso em 09 Fev 2017

Basta enviar alguns dados por e-mail:
E-mail para contato: contato@fopbrasil.org.br
Por ser uma doença muito rara a divulgação é primordial e precisamos muito dessa ajuda. Envie um e-mail para contato@fopbrasil.org.br, com suas dúvidas que responderemos com prazer.
Você pode ajudar de várias formas:
Este recurso útil contém perfis para pessoas com FOP. Ele é completo com fotos e informações de contato, para que você possa entrar em contato com outros membros da comunidade. O Diretório é útil para que seja possível se conectar com as pessoas que vivem perto de você ou pessoas da mesma idade.
Nós compartilhamos algumas das perguntas mais frequentes abaixo. Se você tiver outras dúvidas, entre em contato com Marianns Gomes vice-presidente através do email: mariannagomessantos@hotmail.com ou através da página.
Os pacientes podem criar um perfil neste link abaixo e dar consentimento (se eles gostariam) de estarem listados no Diretório do Paciente FOP on-line. Eles também podem se juntar ao IFOPA neste link (não há nenhum custo para se tornar um membro).
A boa notícia é que a existe a possibilidade de selecionar o idioma português no menu suspenso no canto superior esquerdo da página e o formulário será automaticamente traduzido.
Ótima pergunta! O Diretório não é o mesmo que o registro FOP. O diretório é um site protegido por senha no fopdirectory.org apenas para uso paciente.
Os dados sobre a experiência da doença no Registro FOP é agregada e fornecida como relatórios resumidos para pesquisadores como uma ferramenta para o estudo da FOP e potenciais tratamentos . O Registro FOP é uma ferramenta fundamental na busca de tratamentos, e um dia uma cura, para a FOP. Você se inscrever e completar 6 meses de estudos de acompanhamento em fopregistry.org
Nós encorajamos aqueles que vivem com FOP para se juntar tanto o Registro FOP quanto ao Diretório FOP.
O acesso é limitado aos pacientes, pais de pacientes menores de 18 anos, e cônjuge / parceiros. Há alguns pais de adultos que vivem com FOP (qualquer pessoa com 18 anos ou mais) que gostaria de ter acesso ao Diretório.
Palovaroteno é um tratamento experimental, com o potencial de prevenir o crescimento anormal dos ossos em pessoas com FOP, uma doença para a qual não existem atualmente tratamentos aprovados. Clementia está estudando palovaroteno em ensaios clínicos de Fase II.
Esse é o site do Clementia. Usando o link o site será traduzido automaticamente.
Use um pouco do seu tempo para conhecer mais de uma industria que está fazendo muito por você!
https://translate.google.com.br/translate?hl=pt-BR&sl=en&u=http://clementiapharma.com/&prev=search
Mais uma esperança de um futuro tratamento para a FOP.
Ensaio Clínico com o medicamento RAPAMICINA deve iniciar no mês de Setembro com cerca de 20 pacientes. Mais uma promessa muito promissora de futuros tratamentos para a FOP.
KYOTO - Os pesquisadores da Universidade de Kyoto estão preparados para iniciar o primeiro Ensaio Clínico mundial de um medicamento identificado usando células IPS.
Uma equipe liderada por Junya Toguchida, professora da universidade, usou células-tronco pluripotentes induzidas para desenvolver uma droga potencial para Fibrodisplasia Ossificante Progressiva (FOP), uma doença rara em que o tecido muscular é gradualmente substituído pelo osso, inibindo o movimento do corpo.
Os pesquisadores criaram células iPS de pacientes com FOP e replicaram o sintoma fora de seus corpos. Depois de adicionar componentes às células com características da doença, eles descobriram que - de 6.800 substâncias - um agente imunossurpresor chamado Rapamicina foi eficaz para prevenir a formação óssea anormal.
A segurança e a eficácia da droga precisam ser testadas em um ensaio clínico, que pode começar em setembro, com cerca de 20 pacientes com idade igual ou superior a 6 anos. Um comitê de revisão do Hospital da Universidade de Kyoto já aprovou o ensaio clínico.
A equipe confirmou a eficácia da Rapamicina em experimentos com camundongos. Os pesquisadores deram o agente aos camundongos após o transplante de células iPS dos pacientes com FOP, e descobriram que a droga inibia a formação óssea anormal.
"A Rapamicina é uma droga já utilizada (para o tratamento de outras doenças), então espero que os pacientes a aceitem" no ensaio clínico, disse Toguchida em uma coletiva de imprensa em Kyoto lotada com dezenas de repórteres e várias câmeras de televisão - refletindo o forte interesse no ensaio clínico.
"Nós demoramos muito para chegar até aqui", disse Toguchida, acrescentando que existem atualmente cerca de 80 pacientes com FOP no Japão.
Ele disse que muitos dos pacientes estudaram seus sintomas e têm uma compreensão científica do transtorno. Makoto Ikeya, professor associado e membro da equipe, disse que espera que o novo ensaio dê esperança aos pacientes do FOP.
Shinya Yamanaka, professor da Universidade de Kyoto e vencedor do Prêmio Nobel de medicina 2012 para descobrir células iPS, disse: "Espero que o ensaio clínico estimule a pesquisa ativa para desenvolvimento de drogas e, eventualmente, leve a descobertas de novos tratamentos para várias doenças raras. "
O laboratório Regeneron Pharmaceuticals publicou hoje o início do seu ensaio clínico em clinicaltrials.gov
O estudo visa examinar a segurança, tolerabilidade e os efeitos do REGN2477 em formação óssea anormal de pacientes com Fibrodisplasia Ossificante Progressiva.
Ainda não é possível se inscrever nesse estudo.
Para maiores informações acesse:
https://www.clinicaltrial.gov/ct2/show/NCT03188666?term=regn2477&rank=2.
Regeneron compartilha atualizações sobre seu programa de pesquisa em andamento da FOP
Temos o prazer de compartilhar algumas atualizações interessantes sobre nosso trabalho contínuo para ajudar a melhorar a vida das pessoas com FOP. Regeneron está investigando a FOP há duas décadas e atualmente está focado em estudar REGN2477, tratamento promissor de investigação para FOP que foi concedido status de designação de medicamento órfão da Food and Drug Administration dos EUA e da Agência Europeia de Medicamentos. REGN2477 é um anticorpo monoclonal humano que bloqueia a Activina A, uma proteína descoberta por nossos cientistas como um fator chave no desenvolvimento da ossificação heterotópica (surtos) em um modelo de ratos com FOP.
No início deste ano, concluímos nosso primeiro estudo em humanos para avaliar a segurança e a tolerabilidade de REGN2477 em uma ampla gama de doses. Realizamos nossa primeira reunião do Conselho Consultivo de Pacientes com 12 membros da comunidade FOP para obter importantes descobertas em primeira mão sobre os desafios enfrentados pelos pacientes com FOP. A discussão nos ajudou a entender melhor as necessidades multifacetadas da população FOP, e estamos incorporando essas aprendizagens no projeto do estudo de Fase 2 em pacientes planejados para este ano.
A Regeneron é uma das principais empresas de biotecnologia dos EUA que tem sido administrada por médicos-cientistas há quase 30 anos. Estamos dedicados ao desenvolvimento de medicamentos que mudam a vida de pacientes com condições médicas graves. Temos até agora desenvolvido quatro tratamentos aprovados; Tudo através da pesquisa original Regeneron. Alguns destes medicamentos são para pacientes com condições relativamente comuns, como certas doenças causadoras de cegueira. Outros são para pacientes com condições genéticas menos comuns, como a hipercolesterolemia familiar heterozigótica ou Síndromes Periódicos Associados à Criopirina (CAPS), um conjunto de doenças raras, ainda intimamente relacionadas, auto-inflamatórias. Além da FOP, atualmente temos medicamentos de investigação em desenvolvimento para artrite reumatóide, asma, dermatite atópica, câncer e Ebola. Por favor, fique atento para atualizações sobre o nosso progresso e visite www.regeneron.com para saber mais.

Stéphanie Hoffmann e Eric Soliman, da Clementia Pharmaceuticals, visitaram o Brasil para iniciar os preparativos para o ensaio clínico fase 3 do palovaroteno e para implementar um projeto intitulado "Projeto Narrativo FOP". O objetivo primário deste projeto é compreender como o sistema de saúde brasileiro atualmente apóia o diagnóstico e o atendimento de pacientes com FOP.
Stéphanie e Eric apreciaram muito a simpatia do povo brasileiro. Com o precioso apoio da Dra. Patricia Delai, eles se reuniram com alguns membros da comunidade FOP Brasil, e ficaram emocionados pela atenção recebida, pela valiosa ajuda e pelo tempo dispensado a eles por todos os pacientes que foram visitados e gostariam muito de agradecer mais uma vez a todas as famílias que abriram suas casas para recebe-los. Voltaram aos seus respectivos países de origem inspirados pela determinação e esperança de todas as famílias visitadas no Brasil!
Eles vão continuar trabalhando duro e com um grande senso de urgência com os seus colegas e com toda a comunidade FOP, a fim de se preparar para a implementação do estudo clinico fase 3 do uso do palavaroteno para pessoas com Fop que está sendo conduzido pelo laboratório Clementia. Este estudo irá avaliar a segurança e a eficácia do palovaroteno em prevenir a formação de novos ossos.
A boa notícia é que este próximo estudo de fase 3 também vai acontecer no Brasil e a Dra. Patricia Delai será a Investigadora Principal encarregada da implementação deste estudo.
FIQUE ATENTO - INFORMAÇÕES MAIS DETALHADAS SOBRE ESTE ESTUDO SERÃO COMUNICADAS EM BREVE.

A Clementia relata os resultados mais importantes de seu estudo clínico de fase 2 referentes ao palovaroteno em fibrodisplasia ossificante progressiva (FOP).
Gostaríamos de agradecer as comunidades de pacientes com FOP e médicos, sem os quais nosso programa de fase 2 não teria sucesso. Os investigadores, suas equipes de pesquisa clínica e os participantes, familiares e cuidadores proporcionaram liderança, apoio, comprometimento e participação durante todo o programa. Incluímos 40 participantes no estudo clínico de fase 2 e aproximadamente 100 no estudo de história natural; ambos os estudos produziram conhecimento útil para o avanço das metas da comunidade envolvida com a FOP para compreender a doença e desenvolver tratamentos.
Palovaroteno é um produto medicamentoso experimental que o Clementia está desenvolvendo como tratamento administrado via oral para fibrodisplasia ossificante progressiva (FOP).
Acredita‐se que o palovaroteno, previne a OH na FOP devido à interrupção destes sistemas de transmissão de sinais (na via BMP). Estudos pré‐clínicos em modelos de camundongos com FOP demonstraram que o palovaroteno bloqueou a OH (surto), induzida por lesão e espontânea, manteve a mobilidade e normalizou o crescimento do esqueleto. A variação de dose de fase 2 do palovaroteno foi concluída. Em uma análise preliminar de dados, foi observada uma redução de 97% da nova formação de OH (surtos) nos participantes recebendo palovaroteno diariamente e que aumentaram a dose em comparação aos participantes não tratados ou tratados com placebo (tomaram farinha). O estudo clínico MOVE de fase 3 está sendo realizado para confirmar estes achados.
O palovaroteno foi estudado em mais de 800 humanos, incluindo voluntários saudáveis, pessoas com enfisema e pessoas com FOP.
O Palovaroteno recebeu a designação "Fast Track and Breakthrough Therapy" (terapia inovadora e urgente) da Agência de Administração de Alimentos e Medicamentos dos EUA (Food and Drug Administration, FDA), (funciona como a ANVISA do Brasil), e a designação de medicamento órfão para o tratamento de FOP da FDA e da Agência de Medicamentos Europeia (European Medicines Agency, EMA).
O que é uma designação de medicamento órfão?
A designação de medicamento órfão para palovaroteno foi concedida pela Agência de Administração de Alimentos e Medicamentos dos EUA (FDA) e pela Agência de Medicamentos Europeia (EMA) em reconhecimento de que a FOP é uma doença rara e gravemente debilitante para a qual há falta de tratamentos eficazes.
O que é uma designação de terapia urgente ("Fast Track")?
A designação de terapia urgente ("Fast Track") para palovaroteno foi concedida com base no reconhecimento, por parte da Agência de Administração de Alimentos e Medicamentos dos EUA (FDA), ou seja, como a ANVISA do Brasil, da natureza séria da FOP e da possibilidade do palovaroteno ser benéfico no tratamento da doença.
Por que o estudo de História Natural do Laboratorio Clementia é tão importante para as pesquisas?
Toda doença tem um curso natural. Um caminho que ela segue se não for tratada ou curada. Com a FOP não é diferente.
Para que medicamentos possam ser testados e seus resultados avaliados, é preciso saber o que aconteceria se não tivéssemos dado nada, o que a FOP seria sem quaquer intervenção.
É muito comum tomarmos um remédio e nossa boa vontade, nosso desejo de sarar ou melhorar nos enganar. Acharmos que estamos melhores e na verdade não estarmos.
Por este motivo, saber, não apenas por relatos, mas também com exames como a FOP evolui sem remédios é tão importante.
Dessa forma, quando um remédio for realmente eficaz será fácil sabermos que foi ELE quem melhorou a situação do paciente.
Com tantas promessas hoje de tratamentos para a FOP, é fácil encontrarmos remédios que na verdade não têm ação nenhuma ou talvez muito pouca. Dessa forma, é preciso ficar alerta sempre ao que o remédio tem de embasamento científico (não existe remédio ou droga confiável sem estudo), e na história natural de sua doença. Só com estes dados você será capaz de avaliar corretamente o efeito de um tratamento.
O estudo MOVE é um estudo clínico de fase 3 global, multicêntrico, em caráter aberto e confirmatório de palovaroteno no tratamento da fibrodisplasia ossificante progressiva (FOP) que prevê a inclusão de aproximadamente 80 adultos e crianças com FOP a partir de 4 anos de idade. Todos os participantes tomarão palovaroteno todos os dias (nenhum placebo) durante dois anos, tomando uma dose mais elevada durante momentos de exacerbação, para determinar se este regime de dosagem de palovaroteno reduz a formação de nova ossificação heterotópica (surtos), em relação aos participantes não tratados. O estudo clínico MOVE avaliará a segurança e a eficácia de palovaroteno em participantes com FOP e completará o pacote de dados que será usado em requerimentos regulatórios globais para aprovações nacionais de palovaroteno como tratamento para crianças e adultos com FOP.
As informações úteis sobre o estudo MOVE estão no site www.clinicaltrials.gov (NCT03312634).
Olá a todos,
Esperamos que vocês tenham feito uma comemoração fantástica no Dia da Consciência da FOP!
23 de abril, (domingo passado), marcou o dia em que o gene da FOP foi descoberto. há 11 anos e por isso é a data que a comunidade estabeleceu como Dia de Conscientização da FOP. Essa descoberta foi o resultado de anos de esforços de uma colaboração bem sucedida em que a Comunidade mundial desempenhou um papel crucial e abriu as portas para o aumento da compreensão da doença, e o desenvolvimento de abordagens terapêuticas e potenciais candidatos terapêuticos.
Marcamos este dia especial no laboratório Clementia com um grupo na sexta-feira (21 de abril), com grande prazer e diversão! Participamos efetivamente da iniciativa "Fun Feet for FOP Day", proposta pela IFOPA. Trabalhar com sapatos loucos, meias.. Nós compartilhamos o almoço em todo o nosso escritório e falamos da nossa alegria e urgência em servir a comunidade FOP. Sua força, determinação e sua consideração são uma fonte de inspiração para cada um de nós em nosso trabalho diário.
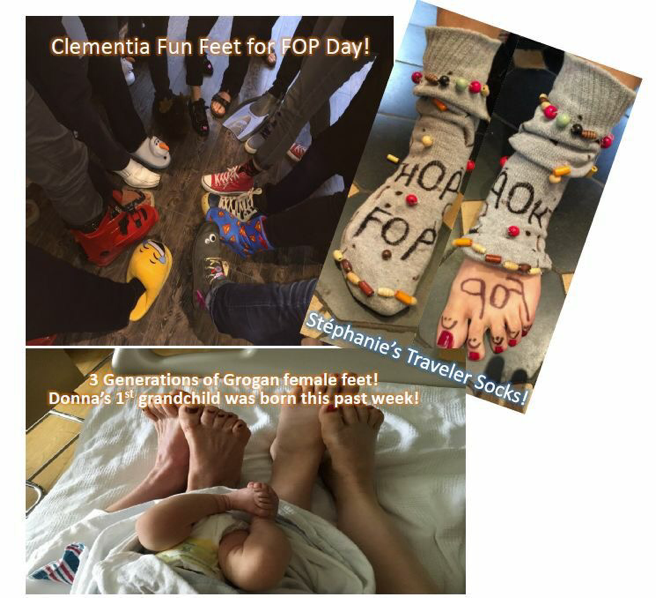
Os grandes destaques do Clementia, como você deve ter lido no último comunicado de imprensa do Clementia, datado em 28 de março de 2017 - dados preliminares do palovaroteno (Fase 2 Parte A Ensaio Clínico).
A partir de agora o Clementia está empenhado nos preparativos para os próximos ensaios de Fase 3: MOVE E REMOVE. O ensaio MOVE é um ensaio que avaliará o efeito do palovaroteno no curso da FOP e o ensaio REMOVE avaliará o efeito do palovaroteno após a excisão cirúrgica de OH (ossificação heterotópica). Nossas equipes médicas e clínicas estão se preparando furiosamente para estes dois ensaios clínicos iminentes, então muitas manhãs, tardes e fins-de-semana são curtos nos escritórios do Clementia.
Paralelamente ao planejamento da próxima fase do programa de desenvolvimento clínico do palovaroteno na FOP, estamos avançando - com o apoio da comunidade FOP - em outras iniciativas-chave que visam melhorar o diagnóstico e o cuidado de pacientes com FOP e, finalmente, preparar sistemas de saúde locais em todo o mundo para permitir o acesso a potenciais inovações terapêuticas, como o palovaroteno para pacientes com FOP.
Em janeiro, revisamos o projeto Narrativo FOP com nossos pesquisadores da Fase 2 em Penn, Mayo e UCSF. Se você participou do IFOPA Drug Development Forum (DDF) em outubro do ano passado, você pode recordar deste projeto. Caso contrário, o nosso objetivo neste projeto é compreender a experiência das pessoas afetados pela FOP com os seus sistemas de saúde locais. Nós visitamos Michelle Davis da IFOPA em Kansas City também e trocamos com ela as iniciativas planejadas em 2017, assim como as principais implicações do projeto Narrativo FOP. Outra reunião muito produtiva e agradável!

Em fevereiro, comemoramos o Dia Mundial das Doenças Raras, com vários presidentes das associações FOP pelo mundo. O evento ocorreu em Bruxelas, na conferência anual da EURORDIS (Organização Europeia de Doenças Raras). A EURORDIS fundou a Dia Mundial das Doenças Raras, há vários anos para concentrar a atenção das comunidades de pesquisa e políticas sobre as doenças raras. O evento, que ocorre no último dia de fevereiro de cada ano, tornou-se muito popular. Enquanto lá, tivemos uma reunião do painel consultivo com os presidentes das associações da FOP. Os conhecimentos reunidos nessa reunião foram preciosos e nos guiarão na implementação de futuros projetos. Este foi um evento produtivo e divertido para todos!

Em março, estivemos no Brasil com o projeto Narrativo Paciente FOP - com a colaboração da Dra. Patricia Delai - que era a atual Presidente da FOP Brasil. Essa iniciativa nos ajudou a compreender melhor a experiência dos pacientes com FOP e o sistema de saúde brasileiro, bem como, de modo geral, os desafios, as necessidades e as expectativas das famílias FOP no Brasil. Trocas ricas e momentos preciosos cheios de emoção! Obrigado a todas as famílias FOP Brasil entrevistadas!
Muito obrigado .

Estudo clínico de fase 2, parte A, de extensão, aberto do palovaroteno para o tratamento de pacientes com fibrodisplasia ossificante progressiva com tendência positiva contínua
MONTREAL, CANADÁ, 24 de março de 2017 - A Clementia Pharmaceuticals Inc. anunciou hoje os resultados preliminares de seu estudo do palovaroteno para o tratamento de fibrodisplasia ossificante progressiva (FOP). Todos os 40 sujeitos que foram incluídos no estudo de fase 2 duplo-cego, controlado por placebo elegeram participar no OLE parte A no qual os participantes receberam o tratamento com palovarotene episódico no caso de qualquer exacerbação adicional. Dados preliminares apoiam os resultados obtidos no estudo de fase 2 duplo-cego: quando os dados foram combinados entre esses dois estudos, o palovaroteno resultou em uma redução de aproximadamente 50% na ocorrência de nova ossificação heterotópica (OH) se comparado ao placebo; e é importante notar que o volume de nova OH diminuiu em 70% para os participantes tratados com palovaroteno se comparado aos participantes tratados com placebo. Palovarotene foi bem tolerado sem que participantes precisassem de escalonamento posológico ou descontinuação do estudo. Quarenta e nove participantes estão agora incluídos no OLE parte B que avalia um regime de dose crônico do palovaroteno.
“Nossa preocupação pela comunidade FOP orienta nosso interesse pela pesquisa”, disse o investigador principal, Dr. Frederick Kaplan, Professor de Medicina ortopédica molecular do Isaac & Rose Nassau, e chefe da divisão de medicina ortopédica molecular da Perelman School of Medicine na University of Pennsylvania, “estamos animados pela evolução desses estudos e esperamos os resultados do estudo piloto de fase 3”. Dr. Kaplan é o investigador principal global dos estudos de fase 2 da Clementia.
A FOP é uma doença genética rara caracterizada pela ossificação heterotópica (OH) progressiva, na qual se acumulam ossos nos músculos, tendões e ligamentos no corpo e nas articulações, obstruindo de maneira constante os movimentos e levando à perda de função, incapacitação e risco de morte precoce. Agonistas seletivos do RARγ como o palovarotene suprimem a OH afetando os elementos inflamatórios upstream, inibindo os efectores downstream do gene ACVR1 mutado (denominados Smads 1, 5 e 8), e redirecionando as células-tronco mesenquimais pré-condrogênicas em um tecido mole não ósseo. A justificativa para testar o palovaroteno na FOP foi baseada em uma publicação de 2011 do Nature Medicine que demonstrou que os agonistas RARγ incluindo o palovarotene inibem potencialmente a condrogênese, assim como inibem a OH . Testes extensivos em modelos pré-clínicos de camundongos transgênicos demonstraram que o palovaroteno bloqueou a OH induzida por lesão e espontânea, manteve a mobilidade e restaurou o crescimento esquelético.
O programa de fase 2 foi desenhado para transferir os efeitos biológicos do palovarotene de animais em laboratório para os indivíduos afetados na clínica por FOP. A Clementia avaliou, assim, quatro diferentes regimes de dosagem e mediu a OH de várias formas diferentes e em diferentes condições. Os dados coletados até o momento se somam à experiência pioneira da Clementia na pesquisa clínica da FOP, e acrescenta conhecimentos para o desenho do estudo piloto iminente de fase 3. 'Temos objetivos ousados”, disse Jeff Packman, diretor de desenvolvimento da Clementia, “e um desenho adaptado de fase 2 nos permitiu acomodá-los avaliando múltiplos regimes de dosagens e várias avaliações com o fim de informar nosso próximo estudo piloto.” Esse estudo clínico de fase 2, de 12 semanas randomizou participantes para três grupos de dose: 10 mg de palovaroteno por 2 semanas seguido por 5 mg por 4 semanas (10/5), 5 mg por 2 semanas seguido por 2,5 mg por 4 semanas (5/2,5), ou placebo. O tratamento foi iniciado em 7 dias após o início de uma exacerbação com avaliações realizadas no período basal, no fim do tratamento (6 semanas), e após um período de observação de 6 semanas (12 semanas). O OLE é composto pelas partes A e B que permitem a variação de dosagem para continuar: A Parte A avaliou o regime 10/5 com exacerbações adicionais e a Parte B está avaliando uma dose diária crônica de palovarotene de 5 mg, com dose aumentada para 20 mg por 28 dias seguida por 10 mg por 56 dias no início de uma exacerbação em participantes com esqueletos maduros, com participantes com esqueletos imaturos recebendo apenas um regime de dosagem para exacerbação.
“Estamos em um momento divisor de águas na história da comunidade com FOP. Pela primeira vez, um medicamento está entrando na fase 3 com o potencial de mudar a trajetória dessa doença. Se os sinais de eficácia que observamos em nossos estudos clínicos de fase 2 se mantiverem na fase 3, acreditamos que este medicamento será o primeiro tratamento aprovado para FOP. Graças aos esforços coletivos da comunidade com FOP, estamos um passo mais próximos da nossa missão de tornar o palovaroteno disponível para todos aqueles afetados pela FOP”, disse Clarissa Desjardins, CEO da Clementia.
Informações adicionais sobre o palovaroteno e o programa clínico da Clementia podem ser encontradas em clementiapharma.com.
Nota do editor: Frederick Kaplan não faz nenhuma declaração.
Recentemente, a Food and Drug Administration (FDA) dos Estados Unidos concedeu a designação de terapia inovadora ao Palovaroteno para a prevenção da ossificação heterotópica (HO) em pacientes com FOP. Somente medicamentos que estão sendo desenvolvidas para uma condição grave, como a FOP, e demonstraram evidências clínicas de que a droga pode demonstrar melhorias em relação à terapia disponível pode ser concedida uma Designação de Terapia Avançada. A designação de
Palovaroteno foi concedida pela US FDA após a avaliação dos dados preliminares do estudo da Fase 2.
Essa notícia nos mostra o quanto estamos perto, o caminho após a fase 3 será mais curto com esse maravilhoso acontecimento.
Clementia lançou há algumas semanas, um comunicado de imprensa anunciando sua presença em duas conferências médicas em setembro de 2017. "Vamos apresentar os dados do NHS, bem como os resultados de alto nível da fase 2 nas conferências da Sociedade Americana de Pesquisa Óssea e Mineral - ABMSR.
Estaremos presentes nessas Conferências com um estande para fins educacionais. Isso ilustra o compromisso do laboratório de aumentar a conscientização sobre o programa de desenvolvimento sobre a FOP e Palovaroteno em comunidade médica".

Caros amigos,
Ontem, dia 9/4/2018, uma nova e importante etapa com relação à vinda do estudo clinico do laboratorio Clementia (palovaroteno) ao Brasil foi vencida: recebemos a aprovação do estudo pela Anvisa.
Inicia-se agora a etapa final antes da ativação do estudo, que é a importação da droga.
Temos uma idéia de que isto poderá demorar por volta de 60 dias porém não é possivel prever exatamente.
Esperamos e faremos todo o possivel para que isto ocorra rápido, uma vez que a rapidez é importantissima por contarmos com um estudo mundial e com vagas limitadas.
Manteremos a todos informados periodicamente.
Um abraço,
Além das provas clínicas de Palovarotene e o "Projeto Narrativo", a Clementia lançou em 2014 o programa "História Natural de FOP" que não envolve nenhum tratamento. Nele os pacientes passam por medições e exames para registrar as caracteristicas clínicas, o estado funcional e também a eventual evolução da doença. Algumas familias do Brasil estão participando na sede Buenos Aires (Hospital Italiano). A conclusão está prevista para 2019. As informações correspondentes você pode achar aqui
Encontro com a Dra Patrícia e a querida Stephanie Holfmann. Esperanças renovadas... agradecemos a oportunidade de poder dividir nossa trajetória e agradecemos o empenho dessa equipe. Um abraço família Schaker.
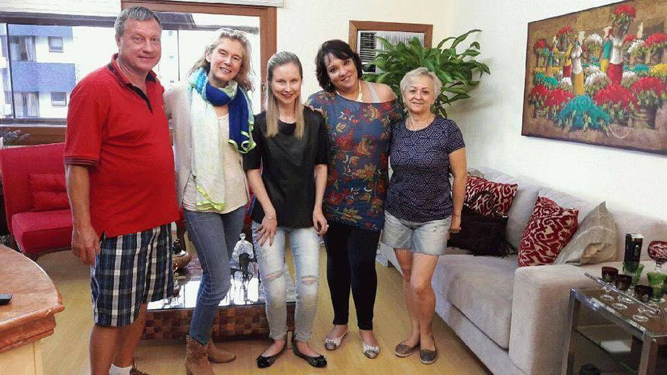
A visita da dra. Patrícia Delai e da Stéphanie Holfmann, representante do Clementia, além de ter sido esclarecedora, foi um divisor de águas, porque agora tudo parece mais real, mais palpável. O tratamento logo estará aí, ao acesso de todas as pessoas com FOP. E mesmo eu não podendo participar dos testes, ajudarei da forma que puder, para que no futuro crianças com FOP sejam diagnosticadas e tratadas logo.
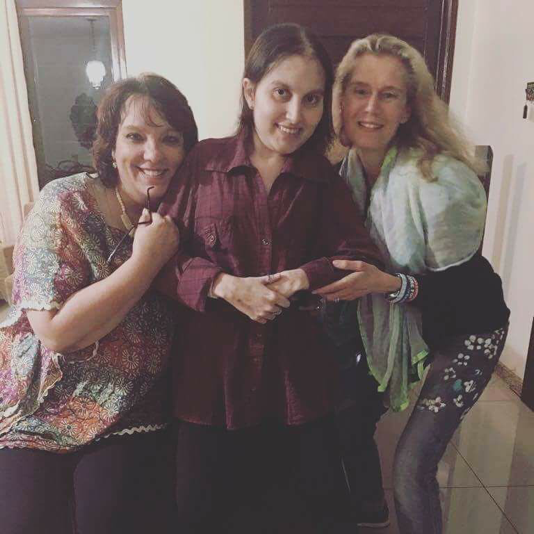
Há muito esperávamos por isso. Agora estamos felizes por poder comunicar que o Brasil entrou na rota do medicamento Palovaroteno, produzido pelo Laboratório Clementia.Após muitas pesquisas e ensaios clínicos, foi possível amenizar os surtos e dores provocadas pela FOP.
Hoje, agradeço por ser convidada a dar esse passo juntamente com a Clementia e a equipe da FOP BRASIL para dar continuidade à pesquisa.
Na entrevista com a Stephanie Hoffmann e Patricia Delai, eu e minha família pudemos esclarecemos as dúvidas que tínhamos em relação a este projeto.

O laboratório Clementia, responsável pelos ensaios clínicos com o Palovaroteno, está conduzindo também o "Projeto Narrativo do Paciente FOP" em vistas à preparação da correspondente fase 3. Este projeto complementário que envolve entrevistas com famílias e comunidades médicas, pretende documentar a experiência de pacientes FOP com o sistema de saúde de cada país e, desse modo, facilitar o planejamento desta fase decisiva, com inicio previsto para este ano.
Neste mês de março se completaram as primeiras visitas às famílias participantes no Brasil.
As entrevistas abordaram as dificuldades experimentadas no diagnóstico, a atenção médica que os pacientes requerem atualmente, o acesso aos serviços de saúde e o modo em que são afrontadas as necessidades especiais em cada caso particular. Os representantes de Clementia esclareceram algumas questões sobre as fases já em andamento em outros países (fase 2 e 2 estendida). Também se deixou constância da necessidade de preencher critérios de elegibilidade para a eventual participação nas provas clínicas.
Espera-se que a informação recolhida com as famílias contribua para formar um quadro da resposta e o acompanhamento que o sistema de saúde é capaz oferecer aos pacientes com Fop. Em consequência, as condições em que poderá se desenvolver a fase 3 serão avaliadas cuidadosamente pelo laboratório para segurança e benefício do participantes. No entanto os dados fornecidos serão tratados com o devido sigilo para preservar a intimidade de cada paciente.
Ainda não é possível dizer quanto de alivio o Palovaroteno trará aos pacientes. Qualquer novo tratamento deve vir precedido de múltiplas provas e monitoramento rigoroso, para evitar efeitos colaterais danosos e para comprovar a real eficácia. No caso do Palovaroteno, esse estágio ainda está em curso, mas já bastante avançado: é a chance que a comunidade Fop espera há tanto tempo.
A família Andreani de Campinas recebeu a Stéphanie Hoffmann e Eric Soliman do Clementia. Esteve presente também a doutora Patricia, que participa na implementação local do projeto e faz a mediação entre pacientes e os representantes do laboratório.

José Carlos Martins Júnior – Residente em Odontologia Hospitalar
Dr Luiz Alberto Valente Soares Júnior e
Dra Camila Mérida Carrillo.
É com imensa satisfação que a FOP BRASIL anuncia a equipe de dentistas especialistas em FOP na cidade de São Paulo.
Essa equipe está realizando uma pesquisa com os pacientes que têm como objetivo avaliar a qualidade de vida relacionada à saúde bucal em pacientes com FOP. A pesquisa se extenderá até dezembro de 2017.
Caso o participante necessite de tratamento dentário clinico (restaurações de resina, extrações e limpeza, apenas), ele será realizado nessa instituição. Para agendar basta entrar em contato com a Associação através dos e-mails: contato@fopbrasil.org.br ou mariannagomessantos@hotmail.com ou ainda pelo WhatsApp com a vice-presidente 13996942120 Marianna.
Se o paciente optar por participar da pesquisa ele terá comparecer ao hospital no dia da avaliação e nos sucessivos retornos (se necessário).
Será realizado um exame clinico odontológico com o objetivo de avaliar a condição bucal do paciente e também será solicitado o preenchimento de questionários sobre a qualidade de vida.
Os resultados deste trabalho nos ajudarão a entender melhor a condição de saúde bucal dos pacientes com Fibrodisplasia Ossificante Progressiva com o objetivo de estabelecer futuramente possíveis medidas preventivas de saúde bucal.
Não há despesas pessoais para o participante em qualquer fase do estudo, incluindo exames e consultas (exceto alimentação, transporte e eventual custo com estadia). Também não ha compensação financeira relacionada a sua participação.

Entrevista com o dentista especialista em FOP dr Luiz Alberto Valente Soares Júnior, especialista em odontopediatria e pacientes com necessidades especiais. Ele e sua equipe atendem em São Paulo gratuitamente os pacientes com FOP há mais de 10 anos. Conheça um pouco da trajetória do Dr Luiz Alberto com a FOP.
Caso queira entrar em contato com ele ou agendar uma consulta, por favor mande um e-mail para contato@fopbrasil.org.br ou mariannagomessantos@hotmail.com
A segunda parte da entrevista será postada em breve! Aguardem.
Luiz Alberto Valente Soares Junior , cirurgião dentista formado em 1992 na OSEC/ UNISA ex aprimorado de odontologia hospitalar do HCFMUSP
Surpervisor da Divisão de odontologia do HCFMUSP
A vacina da gripe NUNCA deve se administrar a um paciente de FOP durante um SURTO DA DOENÇA quando ela está ativa.
A Campanha Nacional de. vacinação contra a Influenza - o vírus da gripe vai até o dia 1º de Junho. Ele está sendo distribuída gratuitamente nos supostos de saúde. A fórmula deste ano protege contra três tipos do vírus: H1N1 e H3N2 e influenza B.
Fora da Campanha Nacional de Vacinação, ela está disponível nos postos de saúde das redes particulares.
O único evento adverso que raramente aparece é uma leve irritação na pele no local da aplicação, ela NÃO CAUSA GRIPE.
NÃO ESQUEÇA que em pacientes com FOP ela só pode ser administrada na forma SUBCUTÂNEA E NUNCA INTRAMUSCULAR! É necessário necessário laudo médico, e nele DEVE constar que ela precisa ser administrada dessa forma.(subcutânea). Isso é essencial.
Como já sabemos o vírus Influenza PODE PIORAR os surtos da FOP, o correto é que os outros membros da família do paciente também tomem a vacina, assim como é importante informar na escola no caso de crianças.
Para os pacientes que não podem sair de casa, é importante levar o laudo médico (que ateste também essa condição), e documentos pessoais para se informar como administrar a vacina. Em algumas cidades, isso já está sendo agendado é esse paciente receberá na data determinada a imunização em casa.
A vacina da gripe nunca deve ser administrada a quem tem alergia a ovo e seus derivados (desde que é desenvolvida e cultivada em ovos.) A vacina da gripe também não deve ser administrada a alguém que já teve uma reação adversa severa a essa vacina.
Referências aqui acesso: 11 de Junho de 2018.Neste ano de 2019, a Clementia espera registrar junto à Administração de Alimentos e Medicamentos (Food and Drug Administration, FDA) dos Estados Unidos o primeiro requerimento de aprovação regulatória para um possível tratamento da FOP. Após seis anos ao mesmo tempo desafiadores e incríveis, poder escrever estas palavras é como ver um sonho se tornar realidade. Agradecemos sua confiança e apoio.
Não poderíamos ter chegado até aqui de maneira tão rápida sem o esforço da equipe de 53 funcionários da Clementia, nossos investigadores de estudo clínico e suas equipes, além de um grupo de apoio formado por consultores e subcontratados de todo o mundo. No total, mais cem pessoas do mundo inteiro trabalharam com satisfação milhares de horas para levar adiante esse possível tratamento e nosso trabalho ainda não está terminado. Para que tudo isso fosse possível, já foram investidos até agora centenas de milhões de dólares. E a Clementia continuará realizando investimentos consideráveis para concluir nossos registros regulatórios e estudos clínicos em curso, bem como para criar uma organização global que será capaz de disponibilizar o palovaroteno — uma vez aprovado — a pessoas que tanto precisam.
Hoje, todos na Clementia estamos inteiramente empenhados no envio de uma requisição de novo medicamento nos Estados Unidos no segundo semestre de 2019 e também estamos analisando qual o melhor caminho para obter a aprovação na Europa e em todo o mundo para o palovaroteno, uma terapia em investigação. Gostaríamos de agradecer às autoridades reguladoras do mundo todo por sua colaboração ao avaliarem o palovaroteno e nossos programas.
Neste momento em que evoluímos de uma empresa de desenvolvimento clínico para nos tornarmos uma grande organização comercial autossustentável e totalmente integrada, queremos reiterar nosso compromisso com vocês. O investimento da Clementia na comunidade envolvida com a FOP não se encerrará com o envio de nosso acordo de não divulgação ou, se recebermos a aprovação, com o lançamento no mercado. Continuaremos avaliando medicamentos promissores ou futuras tecnologias que possam promover novas e importantes descobertas capazes de melhorar os resultados para os pacientes. Prometemos seguir trabalhando com vocês tendo em mente seus mais nobres interesses e em benefício de todos os nossos colaboradores e partes interessadas.
Desejamos o melhor a vocês e suas famílias,
Clarissa
O ICC - Conselho Clinico Internacional para. FOP, publica informações sobre is cuidados que devem ser tomados para evitar o Covid-19 para pessoas com FOP.
Estes cuidados são atualizados com bastante frequência e por este motivo em vez de traduzir vamos deixar aqui o link para o site do ICC - www.iccfop.org . Na primeira página estas informações ja aparecem e para traduzir basta copiar e colar no tradutor do próprio Google.
Cuidem-se!